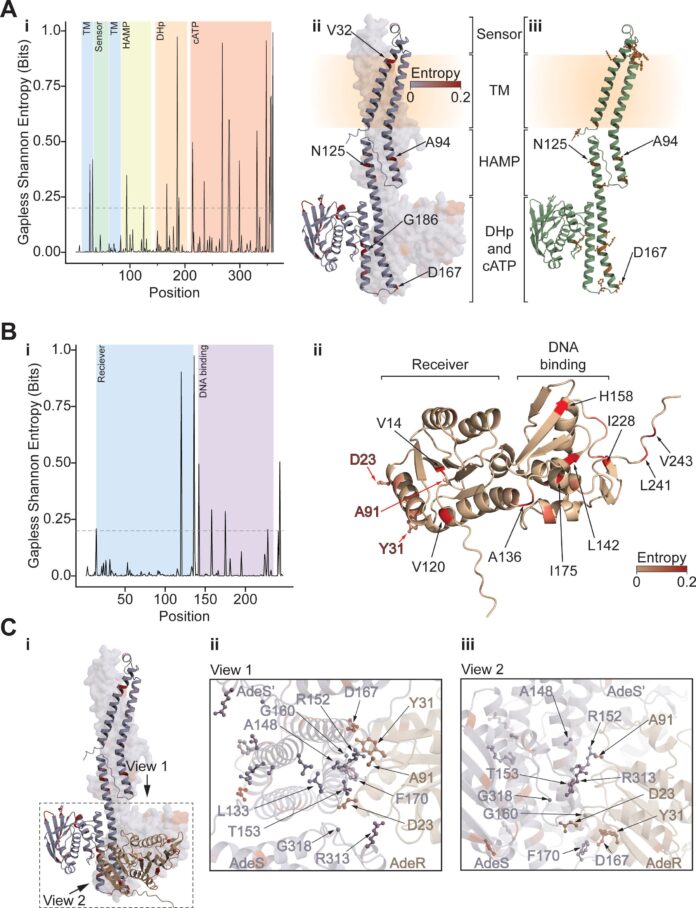
Acinetobacter baumannii (A. baumannii ) rappresenta una minaccia significativa e crescente all’interno degli ospedali statunitensi, colpendo oltre un paziente su cento. Questo batterio è noto per il suo genoma adattabile e il rapido sviluppo di resistenza agli antibiotici, che rendono le infezioni difficili da trattare e spesso portano a gravi conseguenze.
La minaccia crescente di A. baumannii Infezioni
La preoccupazione che circonda A. baumannii è sottolineato da ricerche che indicano che circa un terzo delle infezioni contratte in ospedale da questo batterio negli Stati Uniti dimostra resistenza ai carbapenemi, una classe cruciale di antibiotici. Queste infezioni resistenti sono associate a un aumento dei tassi di mortalità, a degenze ospedaliere prolungate e a frequenti trasferimenti in altre strutture sanitarie: risultati che evidenziano l’urgenza di comprendere e combattere questa minaccia batterica.
Mappatura dei meccanismi di resistenza: un approccio sperimentale all’evoluzione
I ricercatori della Sanford Burnham Prebys e della Roche Pharmaceuticals hanno recentemente pubblicato i risultati in Antimicrobial Agents and Chemotherapy, descrivendo in dettaglio un nuovo approccio per mappare le mutazioni genetiche che guidano la resistenza agli antibiotici nell’A. baumannii. Il loro metodo utilizza una tecnica di “evoluzione sperimentale”, concentrandosi su due antibiotici non comuni, la tigeciclina e la colistina, spesso considerati difese di ultima linea contro l’A. infezioni da baumannii.
“Questi antibiotici rappresentano l’ultima risorsa a disposizione dei medici per le infezioni da A. baumannii “, ha spiegato Andrei Osterman, Ph.D., professore coinvolto nella ricerca. “Anche se la resistenza è attualmente relativamente bassa negli Stati Uniti, è in aumento, spingendo la nostra indagine su come questi batteri acquisiscono nuovi meccanismi di resistenza”.
Il Morbidostat: una macchina per l’evoluzione batterica
L’approccio innovativo del team sfrutta un dispositivo specializzato chiamato morbidostat. Questo sistema consente la crescita batterica continua sotto crescente pressione antibiotica su più generazioni. Un computer controlla il processo, monitorando il tasso di crescita della coltura e introducendo progressivamente concentrazioni crescenti del farmaco antibiotico, imitando efficacemente le condizioni all’interno del corpo umano: uno scenario più realistico rispetto ai tradizionali metodi di laboratorio.
“Consideratela come una macchina evolutiva”, ha descritto Osterman. “In combinazione con il sequenziamento genomico, ci consente di costruire una mappa completa di praticamente tutte le possibili mutazioni che conferiscono resistenza agli antibiotici”.
Risultati chiave: percorsi di resistenza per tigeciclina e colistina
Gli sforzi di mappatura dei ricercatori hanno confermato e ampliato con successo le conoscenze esistenti riguardo ai meccanismi primari di resistenza sia alla tigeciclina che alla colistina. Per la tigeciclina, la via più comune verso la resistenza prevede mutazioni che potenziano l’attività delle pompe di efflusso – sistemi all’interno dei batteri che isolano e rimuovono il farmaco prima che possa danneggiare la cellula.
“Si tratta di un meccanismo ben consolidato”, ha osservato Osterman, “e i nostri risultati ampliano in modo significativo la nostra comprensione della gamma di mutazioni coinvolte nel determinare la resistenza alla tigeciclina in A. baumannii.”
Per quanto riguarda la resistenza alla colistina, il team ha identificato mutazioni che influenzano l’attività di un enzima specifico. Queste mutazioni ostacolano la capacità dell’enzima di trasportare l’antibiotico al bersaglio previsto all’interno della parete cellulare batterica.
Genomica predittiva: un percorso verso un trattamento mirato
I ricercatori sono ottimisti sul fatto che queste conoscenze appena acquisite possano essere utilizzate per prevedere la resistenza agli antibiotici in contesti clinici. Confrontando la loro mappa completa delle mutazioni di resistenza con i genomi dei batteri isolati dai pazienti, possono fare previsioni sulla sensibilità ai farmaci e prendere decisioni informate sul trattamento.
“Ora abbiamo accesso a oltre 10.000 genomi pubblicamente disponibili di isolati di A. baumannii, che abbiamo incorporato nella nostra analisi comparativa”, ha spiegato Osterman.
Questa ricerca, combinata con studi precedenti sulla resistenza agli antibiotici in altri agenti patogeni, rappresenta un passo significativo verso previsioni basate sulla genomica della resistenza ai farmaci.
Le conseguenze del trattamento per tentativi ed errori
L’attuale pratica di trattare le infezioni attraverso tentativi ed errori – prescrivendo antibiotici senza sapere se i batteri sono già resistenti – può inavvertitamente accelerare la diffusione della resistenza. “Quando i pazienti vengono trattati con antibiotici ai quali i batteri sono già resistenti, si promuove ulteriormente la resistenza e si perde tempo prezioso che i pazienti potrebbero non avere”, ha concluso Osterman. La capacità di prevedere i profili di resistenza potrebbe rivoluzionare il modo in cui i medici affrontano il trattamento, aprendo la strada a terapie più mirate ed efficaci.