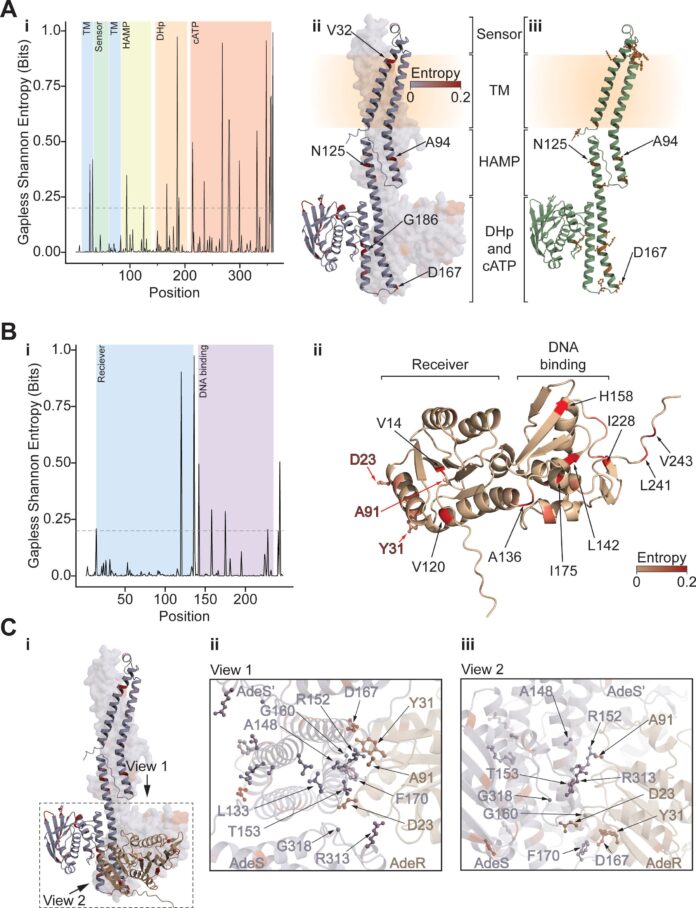
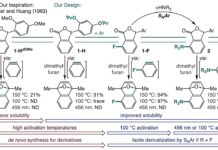
Acinetobacter baumannii (A. baumannii ) representa uma ameaça significativa e crescente nos hospitais dos EUA, afetando mais de um em cada cem pacientes. Esta bactéria é conhecida pelo seu genoma adaptável e pelo rápido desenvolvimento de resistência aos antibióticos, tornando as infecções difíceis de tratar e muitas vezes levando a consequências graves.
A ameaça crescente de A. baumannii Infecções
A preocupação em torno de A. baumannii é sublinhado por pesquisas que indicam que aproximadamente um terço das infecções adquiridas em hospitais por esta bactéria nos EUA demonstram resistência aos carbapenêmicos, uma classe crucial de antibióticos. Estas infecções resistentes estão associadas a taxas de mortalidade aumentadas, internamentos hospitalares prolongados e transferências frequentes para outras unidades de saúde – resultados que destacam a urgência de compreender e combater esta ameaça bacteriana.
Mapeando Mecanismos de Resistência: Uma Abordagem de Evolução Experimental
Pesquisadores da Sanford Burnham Prebys e da Roche Pharmaceuticals publicaram recentemente descobertas em Antimicrobial Agents and Chemtherapy, detalhando uma nova abordagem para mapear as mutações genéticas que impulsionam a resistência aos antibióticos em A. baumannii. O seu método utiliza uma técnica de “evolução experimental”, concentrando-se em dois antibióticos pouco comuns, a tigeciclina e a colistina – frequentemente considerados defesas de última linha contra o A. infecções por baumannii.
“Esses antibióticos representam o último recurso dos médicos para infecções por A. baumannii ”, explicou Andrei Osterman, Ph.D., professor envolvido na pesquisa. “Embora a resistência seja atualmente relativamente baixa nos EUA, está a aumentar, o que levou à nossa investigação sobre como estas bactérias adquirem novos mecanismos de resistência.”
O Morbidostat: uma máquina de evolução bacteriana
A abordagem inovadora da equipe utiliza um dispositivo especializado denominado morbidostat. Este sistema permite o crescimento bacteriano contínuo sob pressão crescente de antibióticos ao longo de múltiplas gerações. Um computador controla o processo, monitorizando a taxa de crescimento da cultura e introduzindo progressivamente concentrações crescentes do antibiótico, imitando eficazmente as condições do corpo humano – um cenário mais realista do que os métodos laboratoriais tradicionais.
“Pense nisso como uma máquina de evolução”, descreveu Osterman. “Combinado com o sequenciamento genômico, permite-nos construir um mapa abrangente de praticamente todas as mutações possíveis que conferem resistência aos antibióticos.”
Principais conclusões: Caminhos de resistência para tigeciclina e colistina
Os esforços de mapeamento dos investigadores confirmaram e ampliaram com sucesso o conhecimento existente sobre os mecanismos primários de resistência à tigeciclina e à colistina. Para a tigeciclina, a via mais comum para a resistência envolve mutações que aumentam a atividade das bombas de efluxo – sistemas dentro da bactéria que isolam e removem o medicamento antes que este possa danificar a célula.
“Este é um mecanismo bem estabelecido”, observou Osterman, “e as nossas descobertas expandem significativamente a nossa compreensão da gama de mutações envolvidas na condução da resistência à tigeciclina em A. baumannii ”.
Em relação à resistência à colistina, a equipe identificou mutações que afetam a atividade de uma enzima específica. Estas mutações dificultam a capacidade da enzima de entregar o antibiótico ao alvo pretendido dentro da parede celular bacteriana.
Genômica Preditiva: Um Caminho em Direção ao Tratamento Direcionado
Os investigadores estão optimistas de que este conhecimento recentemente adquirido pode ser usado para prever a resistência aos antibióticos em ambientes clínicos. Ao comparar o seu mapa abrangente de mutações de resistência com os genomas de bactérias isoladas de pacientes, podem fazer previsões sobre a suscetibilidade aos medicamentos e informar as decisões de tratamento.
“Agora temos acesso a mais de 10.000 genomas publicamente disponíveis de isolados de A. baumannii, que incorporamos em nossa análise comparativa”, explicou Osterman.
Esta pesquisa, combinada com estudos anteriores sobre resistência a antibióticos em outros patógenos, representa um passo significativo em direção às previsões de resistência a medicamentos baseadas na genômica.
As consequências do tratamento por tentativa e erro
A prática actual de tratar infecções através de tentativa e erro – prescrever antibióticos sem saber se as bactérias já são resistentes – pode inadvertidamente acelerar a propagação da resistência. “Quando os pacientes são tratados com antibióticos aos quais as bactérias já são resistentes, promove-se ainda mais a resistência e desperdiça-se um tempo valioso que os pacientes podem não ter”, concluiu Osterman. A capacidade de prever perfis de resistência poderá revolucionar a forma como os médicos abordam o tratamento, abrindo caminho para terapias mais direcionadas e eficazes.