Acinetobacter baumannii (A. baumannii ) представляет собой значительную и растущую угрозу для американских больниц, затронув более одного пациента из ста. Этот бактерий печально известен своей адаптируемой геноме и быстрым развитием устойчивости к антибиотикам, что делает инфекции трудными для лечения и часто приводит к серьезным последствиям.
Растущая угроза инфекций, вызванных A. baumannii
Опасения по поводу A. baumannii подкрепляются исследованиями, свидетельствующими о том, что примерно треть госпитальных инфекций, вызванных этим бактерием в США, демонстрирует устойчивость к карбапенемам, важнейшему классу антибиотиков. Эти устойчивые инфекции связаны с повышенной смертностью, увеличением продолжительности пребывания в больнице и частыми переводами в другие медицинские учреждения – последствия, которые подчеркивают неотложность понимания и борьбы с этой бактериальной угрозой.
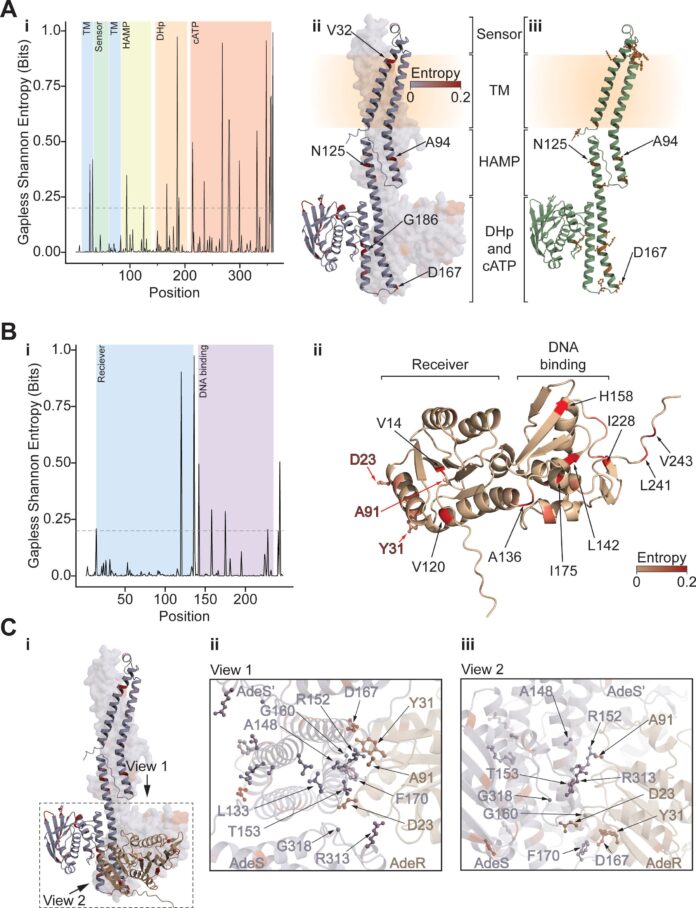
Картирование механизмов устойчивости: экспериментальный эволюционный подход
Исследователи из Sanford Burnham Prebys и Roche Pharmaceuticals недавно опубликовали результаты в журнале Antimicrobial Agents and Chemotherapy, подробно описывая новый подход к картированию генетических мутаций, приводящих к устойчивости к антибиотикам у A. baumannii. Их метод использует технику «экспериментальной эволюции», фокусируясь на двух нечасто используемых антибиотиках, тигециклине и колистине – часто рассматриваемых как последнее средство защиты от инфекций, вызванных A. baumannii.
«Эти антибиотики представляют собой последнее средство врачей для лечения инфекций, вызванных A. baumannii », — объяснил Андрей Остерман, доктор философии, профессор, участвовавший в исследовании. «Хотя устойчивость в настоящее время относительно низкая в США, она растет, что побуждает нас исследовать, как эти бактерии приобретают новые механизмы устойчивости».
Морбидостат: «машина» бактериальной эволюции
Инновационный подход команды использует специализированное устройство, называемое морбидостатом. Эта система позволяет непрерывно выращивать бактерии в условиях возрастающего давления антибиотиков на протяжении нескольких поколений. Компьютер контролирует процесс, отслеживая скорость роста культуры и постепенно вводя возрастающие концентрации антибиотика, эффективно имитируя условия внутри человеческого организма – более реалистичный сценарий, чем традиционные лабораторные методы.
«Представьте себе это как «машину» эволюции», — описал Остерман. «В сочетании с геномным секвенированием она позволяет нам создать всестороннюю карту практически всех возможных мутаций, которые способствуют устойчивости к антибиотикам».
Ключевые выводы: пути устойчивости к тигециклину и колистину
Картирование усилий исследователей успешно подтвердило и расширило существующие знания о основных механизмах устойчивости как к тигециклину, так и к колистину. Для тигециклина наиболее распространенный путь к устойчивости включает мутации, которые усиливают активность насосов эфлюкса – систем внутри бактерий, которые изолируют и удаляют лекарство до того, как оно сможет повредить клетку.
«Это хорошо известный механизм», — отметил Остерман, — «и наши выводы значительно расширяют наше понимание спектра мутаций, участвующих в развитии устойчивости к тигециклину у A. baumannii ».
Что касается колистина, команда выявила мутации, влияющие на активность определенной фермента. Эти мутации препятствуют способности фермента доставлять антибиотик к его предполагаемой мишени в клеточной стенке бактерии.
Прогностическая геномика: путь к целенаправленному лечению
Исследователи оптимистично настроены в отношении того, что эти недавно полученные знания можно использовать для прогнозирования устойчивости к антибиотикам в клинических условиях. Сравнивая свою всестороннюю карту мутаций устойчивости с геномами бактерий, выделенных у пациентов, они могут прогнозировать восприимчивость к лекарствам и принимать обоснованные решения о лечении.
«Теперь у нас есть доступ к более чем 10 000 общедоступных геномов изолятов A. baumannii, которые мы включили в наш сравнительный анализ», — объяснил Остерман.
Это исследование, в сочетании с предыдущими исследованиями устойчивости к антибиотикам у других патогенов, представляет собой значительный шаг к геномно-ориентированным прогнозам устойчивости к лекарствам.
Последствия лечения методом проб и ошибок
Текущая практика лечения инфекций методом проб и ошибок — назначение антибиотиков, не зная, устойчивы ли бактерии — непреднамеренно ускоряет распространение устойчивости. «Когда пациенты лечатся антибиотиками, к которым бактерии уже устойчивы, это еще больше способствует развитию устойчивости и тратит ценное время, которое пациенты могут не иметь», — заключил Остерман. Способность прогнозировать профили устойчивости может революционизировать подход врачей к лечению, открывая путь к более целенаправленной и эффективной терапии.